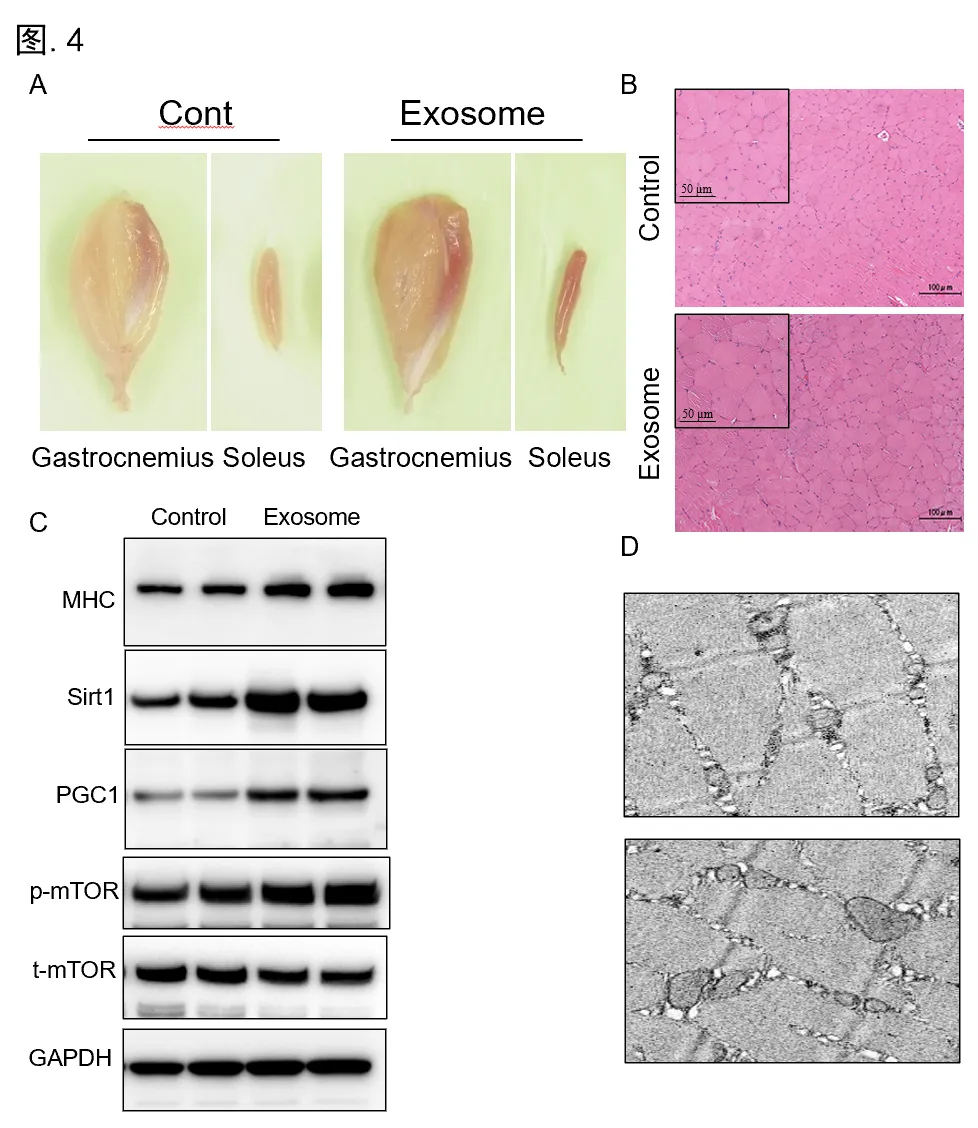
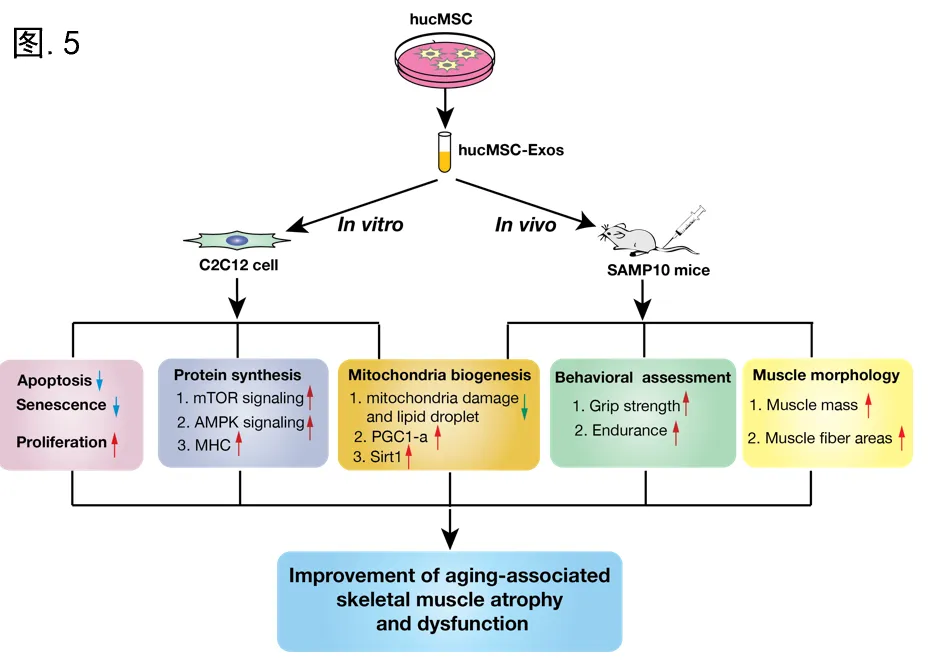
肌少症是机体衰老相关的骨骼肌质量损失和功能障碍,导致体力衰退、衰老型残疾和生活质量降低。而运动训练及药物干预,对于行动不便的老年人来说是不切实际的,且通常会产生不良副作用。因此,迫切需要开发基于衰老相关肌少症分子机制的有效替代品。外泌体是直径为40-160nm的小细胞外囊泡,是细胞间多种生物信号的关键传递者,在许多机体组织的修复中起着至关重要的作用。而人类脐带衍生的间充质干细胞(hucMSCs)具有独特的多谱系分化能力,且因其较其他组织来源的MSCs表现出更快的增殖和更高的迁移能力,人脐带间充质干细胞外泌体(hucMSC-Exos)已被广泛应用于多种人类疾病的治疗。
此次,延边大学附属医院(延边医院)心血管内科成宪武教授课题组与日本名古屋大学附属医院葛谷雅文教授课题组合作的题为“Human Umbilical Cord-Derived Mesenchymal Stem Cell Exosomes Ameliorate Aging-Associated Skeletal Muscle Atrophy and Dysfunction in SAMP10 Mice”的研究论文,在BMC国际权威期刊Stem Cell Research & Therapy杂志成功发表,从而在国际上率先在衰老加速动物模型中证实了hucMSC Exos在衰老性肌少症中的治疗效果及其机制。该论文第一通讯作者是心血管内科成宪武教授,共同通讯作者是心血管内科朴丽梅医生。
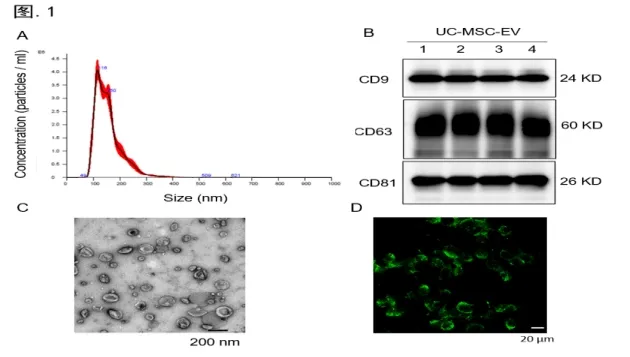
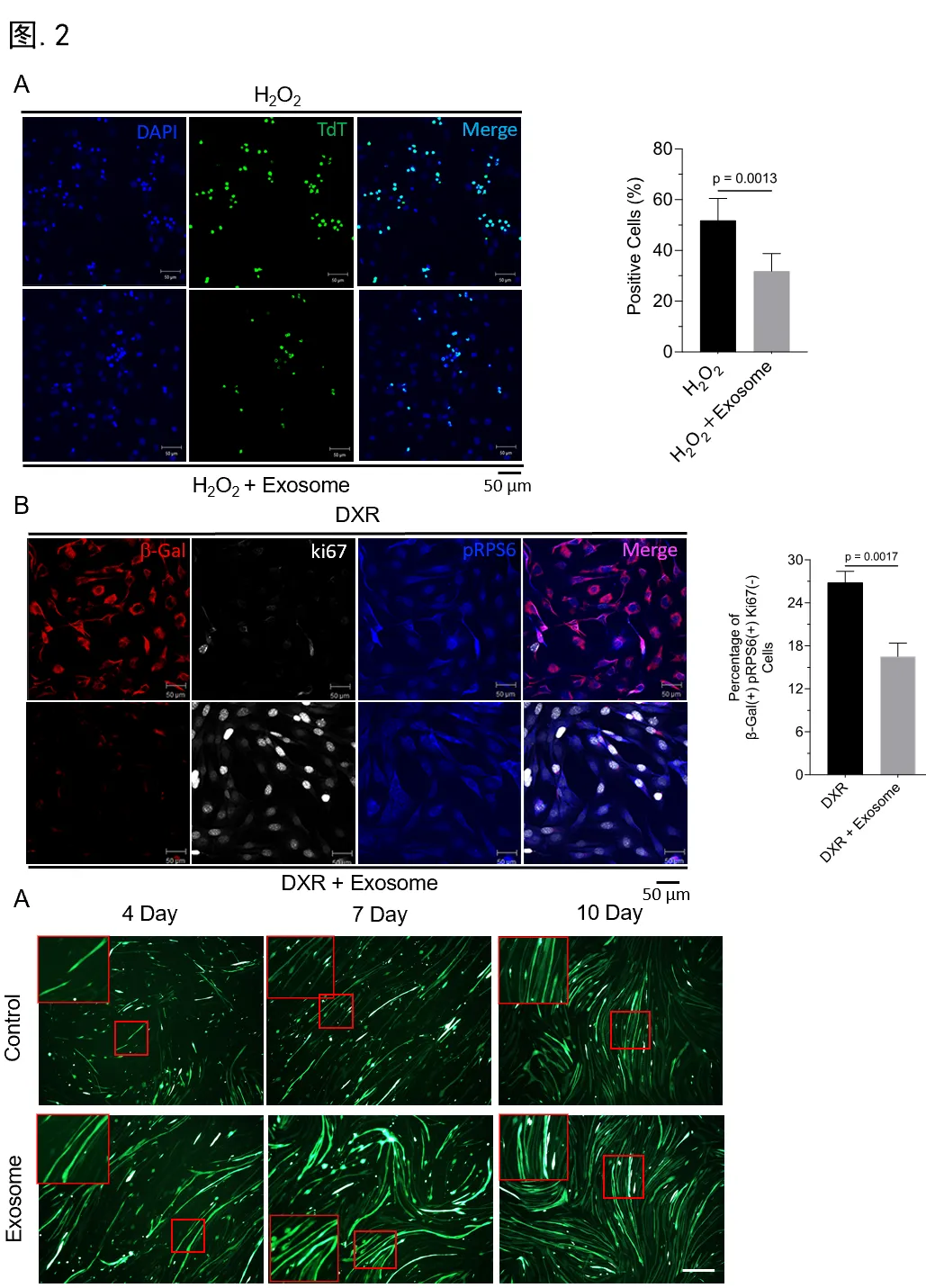
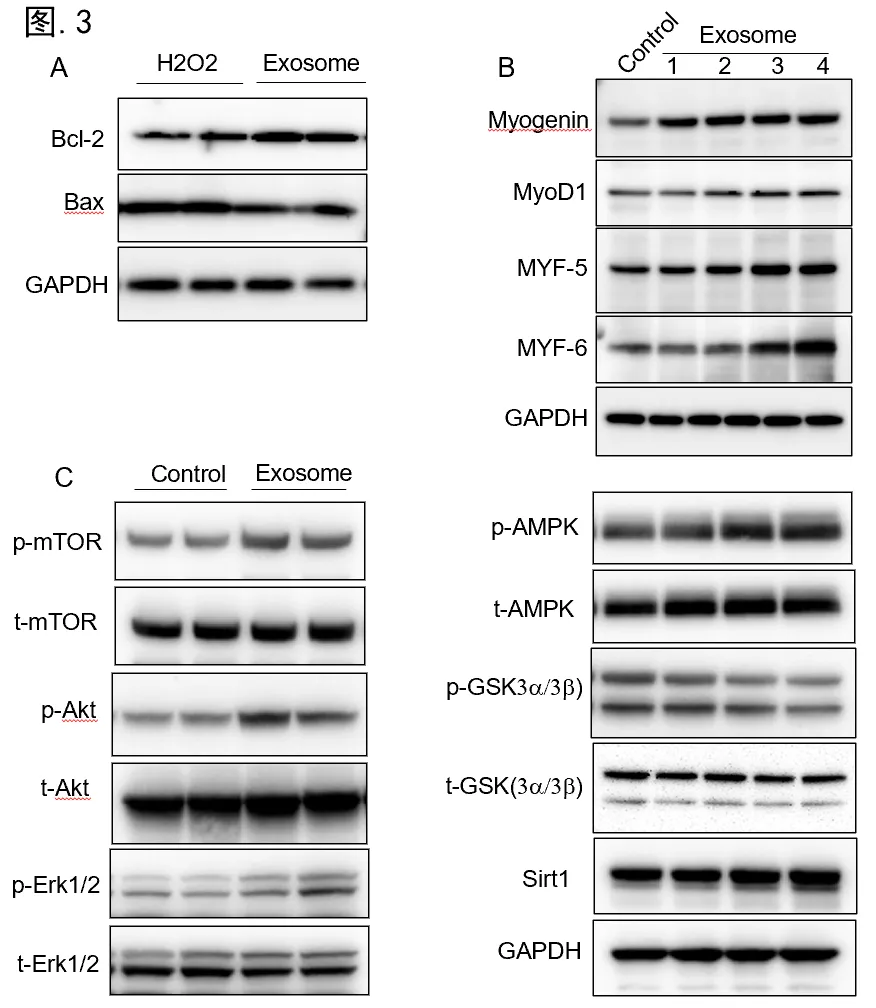
首先,研究hucMSCs中分离外泌体后,通过外泌体标志蛋白质印迹分析、荧光纳米颗粒追踪等技术,对hucMSC-Exos质量进行了充分的鉴定(图.1)。随后,采用H2O2处理C2C12细胞,设置hucMSC-Exos干预组,通过MTT、TUNEL染色等方法评估了hucMSC-Exos在氧化应激中的保护效应。研究发现,hucMSC-Exos不仅可以显著提升细胞存活率,而且降低细胞凋亡比例达38.8%(p=0.0013)(图.2 A)。此外,研究采用三重荧光标记法,在阿霉素(DXR)诱导下,观察到hucMSC-Exos使β-gal+Ki67-pRPS6+衰老细胞减少38.5%(p=0.0017)(图.2 B)。不仅如此,hucMSC-Exos也表现出显著的促C2C12细胞肌源性分化作用(图.3 C)。